实验一 葡萄酒酵母的筛选
葡萄酒型野生酵母在葡萄皮上附着的甚多,所以分离这类醉母并非难事,特别对于采用当地特产葡萄酿制真有特殊风味的葡萄酒,分离本地的葡萄酒型酵母非常必要。但是单分离还是不够的,分离后还必须做酿酒试验,在取得品尝合格的结果后,该分离酵母就可继续作生产试验,并逐步用于生产。
(一)材料
1.分离源:自葡萄园采集数十克葡萄。
2.培养基:取自新鲜葡萄的榨汁,加2%琼脂,若pH小于4,宜调节pH至4~4.5。然后0.6公斤/厘米,20分钟灭菌。可用于斜面,也用于平皿分离用。
3.试管、平皿、接种环,培养箱、漏斗.
(二)操作步骤
1.自葡萄园采集新鲜葡萄数十克,将葡萄用剪刀从枝上剪下。
2.将四层清净纱布铺平,放上葡萄包起来然后用手将葡萄汁挤出,通过漏斗入试管中。于30℃增殖培养48小时,此即为分离源。
3.倒培养基入平皿,待其凝固.取一接种环,沾取葡萄汁,分别划线分离,至30℃培养箱培养。
4.培养48小时,将长出之菌落接入斜面.可随机挑取数十个菌落,但应挑分离成单个的,以免不纯。
5.进行小型酿酒试验。
实验二 紫外线的诱变育种
紫外线诱变一般采用15瓦紫外线杀菌灯,波长主要为2537埃.灯与处理物的距离为15-30厘米,照射时间依菌种而异,一般为几秒至几分钟。紫外线的剂量若灯的功率为30瓦,距离为3厘米时,每平方毫米每秒为53尔格。一般以细胞的死亡率表示。例如如照射的剂量死亡率控制在70-80%为宜。
被照射的菌悬液细胞数,细菌为108个/毫升左右,霉菌孢子和酵母细菌为106-107个/毫升。由于紫外线穿透力不强,要求照射液不要太深,约2~4毫米厚,同时要用电磁搅拌器或手工进行摇动,以免照射不均匀。由于紫外线照射后有光复活效应,所以凡在照射时和照射后的处理应在红灯下处理。、
(一)材料
1.菌种:枯草杆菌AS1.398。经18-20小时肉汁蛋白胨培养液摇瓶培养18-20小时。
2.培养基:牛肉汁蛋白陈固体和液体培养基。无菌生理盐水。
3.器具:10毫升、1毫升无菌吸管,培养皿,试管,三角瓶,摇床,培养箱,离心机,15瓦紫外灯,磁力搅拌器,漏斗,玻璃珠等。
(二)操作步骤
1.将菌培养液3000转/分离心5分钟,倾去上清液,将菌体打散加入无菌生理盐水再离心洗涤。
2.将菌液放入灭菌过,有玻璃珠的三角瓶内用手摇动,以打散菌体。将菌液倒入有定性滤纸的漏斗内过滤,单细胞滤液入试管,一般处于混浊态的细胞液含细胞数可达108/毫升左右,此作为待处理菌悬液。
3.取4-5毫升制备菌液入9厘米培养皿内,放入一无菌磁力搅拌捧,于磁力搅拌器上,在15瓦紫外线下30厘米处。在正式照射前,应先开放紫外线10分钟让紫外灯预热,然后开启皿盖正式在搅拌下照射10-50秒钟。操作均应在红灯下进行,或外用黑纸包住,避免白炽光。
4.取未照射的制备菌液和照射菌液各0.5毫升进行稀释分离,计算活菌细胞数。
5.取照射菌液2毫升于液体培养基中(300毫升瓶,30毫升培养液)进行中间摇瓶培养4小时。
6.取中间培养液稀释分离,培养。
7.挑取菌落进行筛选。
未照射菌液菌数/毫升-照射菌液菌数/毫升
 死亡率%= 未照射菌液菌数 *100%
死亡率%= 未照射菌液菌数 *100%
实验三 营养缺陷型的筛选
(一)材料
1.菌种:啤酒酵母,经诱变,中间培养的菌悬浮液。
2.培养基:CM:蛋白胨2克,酵母浸汁1克,葡萄糖2克,琼脂2克,水100毫升,pH6.0/厘米2灭菌30分钟。葡萄糖2克,KH2PO4 0.l克,MgSO4.7H2O 0.05克,琼脂粉1.5克,蒸馏水l00毫升,pH6.0,0.6公斤/厘米2灭菌15分钟。若不加入(NH4)2SO4和琼脂粉即为无氮液体MM,缓冲液0.1MpH6.0磷酸缓冲液。
3.试剂:制霉菌素
4.器具:无菌吸管、试管、培养皿、离心机、培养箱。
(二)操作步骤
1.取10毫升经15小时中间培养的菌液离心洗涤二次,悬浮于10毫升无氮MM液于三角瓶中,要求细胞浓度为108个毫升,取1毫升菌液至无氮MM中,振荡培养3.5小时。
2.于振荡液中补加1毫升1克/毫升(NH4)2SO4,再加入1毫升浓度为l00微克/毫升的制霉菌素液3 C继续培养2小时。
3.稀释分离,分离得的菌落于CM和MM培养基上点种筛选缺陷型,将选得的缺陷菌落划线分离,挑取20个分离菌落再在MM和CM上点种培养,选取确定的缺陷型菌落。
4.生长谱测定,并传代验证。
5.将确定的营养缺陷型菌株接入斜面作进一步试验。
实验四 葡萄酒的发酵
葡萄酒品种繁多,一般按颜色,糖分多少,有没有添加白兰地或酒精,含不含CO2或酒的产地来分类。
红葡萄洒是用带色果皮的葡萄制成,含有果皮或果肉中的有色物质,酒色深红,鲜灯或 红宝石色,干红葡萄酒含洒精9~13%。
白葡萄酒是用白葡萄或红葡萄的果汁制成,色泽淡黄或金黄色,酒精一般在9~13%。
葡萄酒发酵可以采用天然发酵和纯种发酵二种方式。
(一)材料
1.菌钟:葡萄酒酵母
2.葡萄:白葡萄酒用一般糖度的白葡萄,红葡萄酒用红黑色葡萄,及砂糖。
3.器具:棉塞三角瓶(1升),大漏斗(直径15公分),蒸锅、调羹、纱布、牛皮纸、天平、温度计、糖度计(0~30%)、pH纸,培养箱。
(二)操作步骤
 砂糖
砂糖
原料葡萄——除梗——压榨——葡萄汁+混合——发酵原液——注入三角瓶——湿热灭菌——放凉——加酵母——发酵——过滤——成品。
2.原料的调制及发酵原料的调制。
同一般果汁的制法相同,但红葡萄酒不除种子及皮。对1升三角瓶,需准备红葡萄700克或白葡萄1000克。葡萄汁加砂糖调整糖度至发酵最适的24%的糖度,此为发酵原汁。其计算方法如下:
设果实原糖度为d%,总量为G公斤,现要配制成24%(a%)的发酵原汁,须加糖若干克(x): G*d%十x = 24 (或 a )


 G+x 100 100
G+x 100 100
3.将发酵原汁如入三角瓶达容器高度的1/2为宜。
4.灭菌:塞上棉塞,上包牛皮纸,60℃灭菌20分钟,凉至30℃,加入纯培养菌100毫升左右。
若进行自然发酵,则无须灭菌。
5.发酵与管理:28~30℃恒温培养发酵,每天振摇一次,不宜过多。主发酵约7~10天发酵停止后,过滤之。而后进入后发酵,后发酵期间过滤2~3天,即得澄清液。
实验五 发酵过程中微生物生长、大小和数量的检测
微生物的培养发育,包括培养微生物细胞个体数量的增加(增殖)和细胞物质的增加(成长)。一般在培养微生物时,细胞数量的增加,与细胞物质量的增加之间不一定存在比例关系。但在发育活跃地进行,而且稳定地保持下去,则细胞数量和细胞质量通常就成比例。
1.细胞物质量的测定
(1)干重:将洗净的菌体置于放有干燥剂的干燥器减压干燥,或加热烘干后称重。一般可将洗净菌体摊开于表面玻璃上薄薄一层,然后放红外线烘干器或110一120℃烘箱,烘干至恒重再称量。
(2)菌体含氮量:蛋白质是细胞成分的基本组份,每类微生物细胞的蛋白质含量几乎恒定,如细菌酵母蛋白质含量都占干重的40~60%,霉菌少些。因此将洗涤过的菌体用克氏微量定氮法测定,可以表示出细胞物质的量。
上述两法可用于单细胞细菌、酵母、菌丝、孢子等。
2、细胞菌数计算法,有几种方法如表:
各种菌数技术比较
 方法 设备 适用菌类 最后稀释液 误差% 操作
方法 设备 适用菌类 最后稀释液 误差% 操作
浓度(个/毫升)
计数器法 血球计数板 细菌酵母孢子 106~108 8 菌液吸入计数板与盖片的缝隙中的凹体积内,镜检计数。
平皿法 平皿 细菌酵母孢子 150~1500 以0.2毫升最后稀释液滴于琼脂平皿表面,涂抹培养计数。
毛细管法 容器0.5毫升 厌氧细菌 500~10000 11 以0.2毫升的最后稀释液与4.5
有刻度毛细管 兼性酵母 毫升的1%融化琼脂培养基相混合,吸入毛细管中,凝固,培养,计数。
稀释法 液体培养基试管 细菌酵母 1~10 1~3.3 以10、1、0.1毫升的最后稀释液各入5只试管的培养基中接种。
比浊法 光电比色器 细菌 106~109 培养液应无色,或以对照消去,进行比色,按消光度的比转。
 其中平皿法、毛细管法、稀释法得出的数据为活菌数,而计数器法和比浊法是总菌数的测定。但计数法中若用次甲基兰液染色,则色蓝者为死细胞,活细胞淡蓝色,以资区别。
其中平皿法、毛细管法、稀释法得出的数据为活菌数,而计数器法和比浊法是总菌数的测定。但计数法中若用次甲基兰液染色,则色蓝者为死细胞,活细胞淡蓝色,以资区别。
酵母细胞数的测定
利用血球计数板在显微镜下直接计数,这是一种常用的微生物计数法。此法是将菌悬液放在血球计数器载玻片与盖玻片之间的计数室中,在显微镜下进行计数。由于载玻片上的计数室盖上盖玻片后的容积是一定的,所以根据在显微镜下观察到的微生物数目来计算单位体积内的微生物总数目。
血球计数板上有四条槽而构成三个平合。中间的平台较宽,其中间又被一短横槽隔成两半。每个半边上面各刻有一个计数区,每区分许多大格,其中中央的25个中格为计数区。每个中格又分为16个小方格,即中央大格有25*16=400个小方格组成。每个大方格边长为1毫米,即面积为1平方毫米。盖上盖玻片,载片与盖片间的距离为0.1毫米,于是每大格的体积为0.1毫米3。在计数时,通常数五个中格的总菌数,求得平均值,再乘以25得一大格即0.1毫米3的菌数含量。
计算:A每格中为平均菌数。B为菌液稀释倍数。
则1毫升中菌体数=A*25*10*1000*B
=250000A·B个
=2.5*105A·B个
1、材料
(1)菌液:啤酒酵母发液。
(2)器具:血球计数板,盖玻片,无菌水、无菌试管,玻棒、无菌吸管、显微镜。
2、操作步骤
(1)将原菌液稀释50倍。取0.5毫升稀释菌液入无菌试管内,吸取1%次亚基蓝液入内混均匀。
(2)取清洁干净的血球计数板,加盖玻片于中央,用无菌玻棒沾取染色菌液于盖片周围碰及,依靠毛细作用吸入菌液.注意不能产生气泡,将余液用吸水纸吸去。
(3)静止5分钟,让菌细胞沉于计数器内,开始计数。注意在中格四周的酵母,处于线上的细胞其计数原则是四条边框二边计数,二边不计。酵母的芽在未脱离母细胞前,芽已达母细胞1/2大小可计数。深蓝色为死细胞或衰老细胞,非着色的为一般活细胞。
(4)计数五个中格,然后平均将每中格细胞数代入公式,求出细胞总数。
(5)清洗:用毕后用水冲去计数区,让其自行凉干。
其他实验参见《微生物学实验》(沈萍,范秀容,李广武主编,高等教育出版社,2002),实验十五 微生物大小的测定,实验二十九 平板菌落计数法,实验三十 光电比浊计数法,实验三十一 大肠杆菌生长曲线的测定
实验六 固定化生长酵母细胞连续生产酒精
固定化细饱已应用到L-天冬氨酸和L-富马酸等的工业生产。由于发酵生产往往需ATP再生和辅酶的多级反应,所以要求固定化细胞能处于一种活的状态,即在固定化伏态下仍能继续生长、繁殖。这就是所谓固定化生长细胞。其要点是流入的不仅是糖,而且还是完全培养基。本实验是采用该种形式进行酒精发酵。
(一)材料
1.菌种:酒精酵母或卡氏酵母
2.培养基:
①种子培养基:1%葡萄糖,0.5%蛋白胨,0.3%酵母膏和0.3%麦芽汁,pH5.0
②完全培养基:10%葡萄糖,0.15%酵母膏,0.25%NH4Cl. 0.55%K2HPO4,0.025%MgSO4·7H2O,0.1%NaCl,0.001%CaCl2和0.3%柠檬酸,pH5.0。
(二)操作步骤
1.接种入种子培养基中30℃振荡培养18小时.
2.固定化:将种子培养液1毫升与4%的角叉菜胶溶液50毫升于37 C混合。将这种混和物在20℃滴加到轻微搅拌的2%KCl溶液中,形成了包埋有少量细胞的凝胶珠。具平均直径为4毫米。
3.凝胶珠的再培养:将上述凝胶珠10毫升加到含有100毫升完全培养基的三角瓶中,30℃旋转式摇床上培养60小时,这时的凝胶珠称固定化的生长酵母细胞。
4.用柱式法连续发酵生产酒精:将50毫升固定化生长酵母细胞凝胶装入12.5*2.8厘米的柱中,然后以每小时50毫升的速率30℃加入完全培养基。流出液中即含有5%浓度的洒精,共发酵效率接近100%。也可将包埋少量细胞的凝胶珠直接装入柱中,然后30℃流加完全培养基,待包埋细胞在凝胶中生长繁殖直至达到稳定态,就可进入连续发酵状态。
附:固定化细胞数量的测定
固定化细胞是包埋或吸附于载体之中的细胞,因此与测定游离细胞的方法有区别。这里是测定包埋于凝胶中酵母细胞数的方法。
(一)材料
1.待测凝胶珠
2.培养基:采用培养酵母的完全培养基。
3.器材:生理盐水、吸管、试管、平皿、三角瓶、摇瓶机、培养箱。
(二)操作步骤
1.将从培养基中取出的二粒凝胶珠溶解在5毫升生理盐水中,30℃轻微振荡15分钟。形成细胞悬液。
2.采用稀释法系列稀释分离。30℃培养2天,计数,算出每毫升凝胶中的活细胞数。
实验七 L1523型小型发酵罐的构造
一、实验目的
熟悉小型发酵罐的构造,了解发酵罐各种构造的功能。
二、小型发酵罐的构造
小型发酵罐是实验室进行小规模试验研究的必备装置,图1所示为瑞士比欧生物工程公司生产的L1523型小型发酵罐、主要由罐体、通气系统、搅拌系统、加热及控温系统、监测及控制系统等几个部分组成。















蠕动泵
溶氧
控制器
pH控制器
温度
控制器
发酵罐
电源开关
搅拌器转速控制器
空气
过滤器
热循环泵搅拌电机
| |
排气管空气过滤器
安全阀
压力表
罐盖
玻璃罐体
挡板
空气
进气管
搅拌器及搅拌电机
加热器
| |

图1 L1523型发酵罐的外观


图2 罐体外观 图3 罐体(vessel)



图4 罐盖(lid) 图5 罐底(bottom) 图6 搅拌器(disc turbine)


图7 防护罩(safety jacket) 图8加热器和直流电机(heater and AC motor)

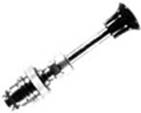
图9 空压机(air compressor) 图10 安全阀(safety valve)
1.罐体
罐体是发酵生产微生物菌体或代谢产物的场所,一般由不锈钢、陶瓷或特种玻璃制成,其体积根据需要可从0.1升到100升不等。L1523型发酵罐的体积为19升,发酵罐的外形参见图2,由罐盖(图4),罐体(图3)和罐底(图5)组成。
(1)罐盖:由耐腐蚀的不锈钢构成,其上有十二个圆孔,分别用于安装pH探头、温度探头、溶解氧探头、气压表、调节pH的补酸、补碱管、排气管过滤器、通气管、放样管和安全阀(图10),靠近外侧的两个孔一般用塞子塞住,主要用于接种、加消泡剂等。
(2)罐体:由耐高温、高压的特种玻璃制成,其内有各种探头、通气管、放样管、搅拌器(图6)和挡板等。
(3)罐底:由具夹层的不锈钢制成,夹层内与加热器和冷却水联通,通过此夹层与发酵罐进行热交换,以控制罐内温度。搅拌器也是通过罐底进入罐体的,称为下搅拌,此外在罐底还有空气分布器,能使压缩空气均匀分布于发酵罐中。
2.通气系统
L1523型发酵罐适用于好气性微生物的发酵生产,其空气来源于空气压缩机(图9)a由空压机压缩的高压空气经除油、除水和减压装置减压后,通过预先灭菌的空气过滤器过滤除菌,然后再经空气分布器、搅拌器和挡板等的共同作用,使无菌空气均匀地分布到整个发酵罐。
3.搅拌系统
发酵罐的搅拌装置可分为上搅拌和下搅拌两种类型,L1523型发酵罐属于下搅拌,其搅拌器(图6)由搅拌电机(图8)驱动,转速高达1000rpm。
4.加热与控温系统
L1523发酵罐为原位灭菌发酵罐,利用自带的小型加热器(锅炉,图8),可进行培养基的灭菌和保温,再借助于冷却水(自来水)可使发酵罐内的灭菌温度和发酵温度精确地保持恒定(误差为士0.1 C)。
5.监测及控制系统
小型发酵罐一般都配备有监测控制系统,可以监测和控制搅拌器的转速、灭菌和发酵的温度、pH值、溶解氧量等。L1523型发酵罐可通过计算机实现自动控制,中间可借助蠕动泵和补料系统自动补料和调节pH值等。
实验八 枯草杆菌的发酵生产
一、实验目的
通过实际操作进一步熟悉小型发酵罐的构造;掌握小型发酵罐的使用方法;了解微生物发酵生产的方法。
二、实验器材的准备
(一)培养基的制备与灭菌
1.斜面菌种培养基
牛肉膏蛋白陈固体斜面培养基:牛肉膏5.0g,蛋白陈10.0g,氯化钠5.0g,琼脂20.0g,水1000ml,pH7.2-7.4,0.1MPa, 121℃,灭菌30min。
每组配制500m1固体培养基,分别装入20支15*150mm试管(每管约5m1)和3个250m1三角瓶中,然后包装、灭菌。试管摆成斜面。
2.三角瓶种子培养基
牛肉膏蛋白脉液体培养基:配方同上,但不加琼脂。
每组配制上述液体培养基1000m1,分装到10个250m1三角瓶中,每瓶1000ml。灭菌方法同上。
(二)其他实验器材的准备
l.lml无菌吸管
每组30支,于0.1 Mpa, 121'C灭菌30分钟。
2.无菌水
18 X 180mm试管,每支装4.5m1水,每组40支,于O.1Mpa, 121℃灭菌30分钟。
3.无菌培养皿
每组40套,于0.1 Mpa,121℃灭菌30分钟。
4.无菌空三角瓶
每组10个,于O.1Mpa, 121℃灭菌30分钟。
5.无菌吸管
1 ml吸管,每组20支,于0.1 Mpa,121℃灭菌30分钟。
6.空气过滤器的灭菌
将空气过滤器针尖先用纱布包扎好,然后再用包装纸和绳子将空气过滤器整体包装好,于0.1 Mpa,121℃灭菌30分钟。
7.牛津杯的灭菌
将50只牛津杯装入培养皿中,每皿10只,用包装纸包装好,于0.1MPa,121℃灭菌30分钟。
8.消泡剂的灭菌
量取100m1豆油倒入250m1三角瓶中(每组3-4瓶),包装好后于0.1 Mpa,121℃,灭菌30分钟。
9.75%和95%的酒精棉球各一瓶
三、细菌细胞浓度的测定(比浊法)
1.标准曲线的制作
取无菌水7支,编号,将在30℃、150rpm条件下培养20~22小时的枯草杆菌细胞按二倍系列稀释法进行适当稀释,使其浓度分别为原液、1/2,1/4,1/8,1/16,1/32,1/64,1/128原液,然后,采用平板菌落计数法测定其中的细胞数量,同时以无菌水作为空白对照,利用分光光度计测定其在580nm波长下的O.D.值。
以O.D.值作为纵坐标,每ml样品中的细胞数作为横坐标,绘制标准曲线。
2.发酵液细胞浓度的测定
从取样管放出10ml左右的发酵液至无菌三角瓶中,在580nm波长下,测定发酵液的O.D.值,对照标准曲线,可知该发酵液的细胞浓度。
四、发酵生产
1.斜面菌种的培养
将已活化两次的试管斜面菌种接种到试管斜面上,30℃培养18~20小时,即为斜面菌种。
2.三角瓶种子的培养
将试管斜面用4.5m1无菌水洗下,然后接种到三角瓶培养基中,每瓶一管,于30℃,150rpm条件下,振荡培养18~20小时。
3.发酵培养基的灭菌
每组配制12L牛肉膏蛋白脉液体培养基(pH7.4),用乳胶管小心地加入发酵罐中,然后旋紧塞子,安装好防护罩(见图7),按下面的方法灭菌:
(1)检查水、电、气以及发酵罐的密封性是否正常。如正常即可灭菌。
(2)插上水泵电源,控制进水阀和出水阀,调节水压使水压表指针指示在0.25~0.3之间,使水充满加热器,防止烧坏加热器。
(3)打开发酵罐的总电源。
(4)打开搅拌器的电源开关,使搅拌器转速控制在300-350rpm。
(5)适当开启排气口排气,但应注意:排气口不能开得过大,否则,培养基的水分损失严重!!
(6)打开温度控制器的电源开关,将灭菌温度设定为121℃,灭菌时间设定为30min,发酵温度设定为30'C.启动灭菌开关,进行自动灭菌。
注意: 1.灭菌过程中决不能离开人!!应随时观察发酵罐有无异常情况,如出现异常应及时请教师处理或关闭总电源。
2.发酵罐的玻璃不能接触冷水!!
3.发酵罐灭菌参数已经设置好,未经教师允许,不得随意改动!!
(7)灭菌结束后,发酵罐会自动降温,当温度低于90℃时,通过无菌操作,
安装好已灭菌的空气过滤器,然后,通入无菌空气,使培养基快速降温,并
使发酵罐保持一定的正压,以减少污染。
(8)当温度低于35℃时即可接种发酵。
4.接种
在发酵罐的罐盖上选择一个塞子,先用75%的酒精棉球在其周围消毒,同时消毒尖嘴钳,然后在塞子周围放置吸满无水酒精的棉花,点燃酒精,用钳子小心打开塞子,取出置于火焰上,将三角瓶种子按5%的接种量迅速倒入发酵罐内,旋紧塞子。
5.发酵
将初始溶解氧浓度调节至95%以上,搅拌速度设定为350rpm,发酵温度设定为30℃,开始计时发酵。发酵时间根据细菌生长情况而定,一般约70小时。
发酵过程中,应注意:
(1)溶解氧的斜率一般不得低于50%,否则需加大搅拌速度或适当增大通气量。
(2)发酵过程中,应经常观察并记录发酵罐内部的变化情况,如泡沫过多,应及时消泡。消泡方法是采用无菌操作技术,打开发酵罐盖顶的一个塞子,加入消泡剂(豆油),每次一瓶(l00ml),但每批次发酵最多不超过4瓶。
(3)发酵过程中应及时记录发酵参数的变化情况。
发酵结束后,应及时的清洗发酵罐和实验用品。
注意:发酵罐体不能用盐酸清洗。
6.绘制枯草杆菌的生长曲线
发酵培养基接种后,从0, 1、2, 3、4、6, 8, 10, 12, 14, 16、18、20, 24, 26, 28, 30,……小时,分别取样测定发酵液的O.D.值,绘制出枯草杆菌的生长曲线。
实验九 抗生素的检测
一、实验目的
通过实验掌握抗生素的一般检测方法。
二、PDA培养基的制备
称取去皮马铃薯200g,切片,放入小锅中,加入1000m1水,加热煮沸10-15分钟,用8层纱布过滤。取滤液加入蔗糖20g,琼脂20g,加热熔化后补足水分(自然pH),然后,分装到20支15 X 150mm试管< 5m1/支)和6个250m1三角瓶(150m1/瓶)中,于O.1Mpa, 121℃灭菌30分钟。
三、抗生素的检测方法
1.将黑曲霉用PDA培养基活化,然后接种到PDA试管斜面上,培养36-48h。
2.取2套无菌培养皿倒入PDA培养基,冷凝后置30℃温箱中过夜。
3.将培养好的黑曲霉试管斜面用4.5m1无菌水洗下,然后将菌悬液分别倒入两套PDA平板上,用玻璃涂棒涂匀。
4.采用无菌操作,用无菌小镊子将牛津杯轻轻放在培养基上。每皿放两只,并作好标一记(参见下图)。
5.分别将发酵20, 30, 40, 50, 60h的发酵液用无菌三角瓶取出,用I ml无菌吸管吸取0.5m1发酵液至一只牛津杯内,另一只加入0.5m1无菌水,共两个重复。
6.静置30min,将培养皿小心放入30℃温箱中,培养48h,观察并记录抑菌圈的大小。
注意:实验过程中,尽量不要移动牛津杯。